فئات: مقالات مميزة » كهربائيين المبتدئين
مرات المشاهدة: 70526
تعليقات على المقال: 0
خلايا كلفانية - جهاز ، مبدأ التشغيل ، أنواعها وخصائصها الرئيسية
الشروط المسبقة لظهور الخلايا الكلفانية. قليلا من التاريخ. في عام 1786 ، اكتشف البروفسور الإيطالي لويجي الويسيو جالفاني ، أستاذ الطب الإيطالي ، ظاهرة مثيرة للاهتمام: عضلات الساقين الخلفيتين لجثة فتحت حديثًا من ضفدع معلقة على خطافات نحاسية متقلبة عندما لمسها العالم بمشارط فولاذية. وخلص جالفاني على الفور إلى أن هذا كان مظهرًا من مظاهر "الكهرباء الحيوانية".
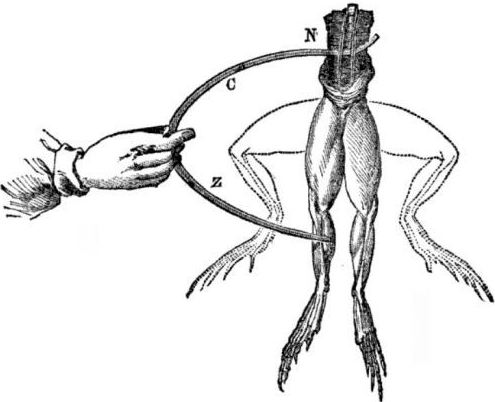
بعد وفاة جالفاني ، سيقوم ألساندرو فولتا المعاصر ، بصفته الكيميائي والفيزيائي ، بوصف وإظهار علني آلية أكثر واقعية لحدوث التيار الكهربائي عندما تتلامس معادن مختلفة.
سيصل فولتا ، بعد سلسلة من التجارب ، إلى استنتاج لا لبس فيه أن التيار يظهر في الدائرة بسبب وجود اثنين من الموصلات من معادن مختلفة وضعت في السائل ، وهذا ليس على الإطلاق "كهرباء الحيوان" ، كما يعتقد غالفاني. كان الوخز في أرجل الضفدع نتيجة لعمل التيار الناشئ عن ملامسة المعادن المختلفة (الخطافات النحاسية ومشارط الصلب).
سوف يُظهر فولتا الظواهر نفسها التي أظهرها جالفاني على ضفدع ميت ، لكن على مقياس إلكتروميتر غير محلي تمامًا ، وفي عام 1800 سوف يقدم شرحًا دقيقًا للتيار: "موصل من الدرجة الثانية (سائل) في المنتصف وهو على اتصال مع اثنين من الموصلات من الدرجة الأولى من اثنين مختلفين المعادن ... نتيجة لذلك ، ينشأ تيار كهربائي في اتجاه أو آخر ".

في واحدة من التجارب الأولى ، خفض فولتا صفحتين - الزنك والنحاس - إلى جرة من الأحماض وربطها بالأسلاك. بعد ذلك ، بدأت لوحة الزنك في الذوبان ، وتشكلت فقاعات الغاز على الفولاذ النحاسي. اقترح فولتا وأثبت أن التيار الكهربائي يتدفق عبر السلك.
وهكذا اخترع "عنصر فولتا" - أول خلية كلفانية. للراحة ، أعطاه فولتا شكل أسطوانة رأسية (عمود) ، يتألف من حلقات مترابطة من الزنك والنحاس والقماش المشبعة بالحامض. خلق القطب فولت نصف متر ارتفاع الجهد الحساسة للبشر.
منذ بداية البحث وضعت لويجي غالفاني ، الاسم مصدر التيار الكيميائي حفظ ذكرى باسمه.
خلية كلفانية هو مصدر كيميائي للتيار الكهربائي ، يعتمد على تفاعل معدنين و / أو أكاسيدهما في المنحل بالكهرباء ، مما يؤدي إلى ظهور تيار كهربائي في دائرة مغلقة. وهكذا ، في الخلايا الجلفانية ، يتم تحويل الطاقة الكيميائية إلى طاقة كهربائية.
خلايا اليوم

تسمى خلايا اليوم البطاريات. ثلاثة أنواع من البطاريات واسعة الانتشار: المياه المالحة (الجافة) ، القلوية (وتسمى أيضًا القلوية ، "القلوية" في الترجمة من الإنجليزية - "القلوية") والليثيوم. مبدأ عملهم هو نفسه كما وصفه فولتا في عام 1800: اثنين من المعادن تتفاعل من خلال المنحل بالكهرباءوينشأ تيار كهربائي في دائرة مغلقة خارجية.
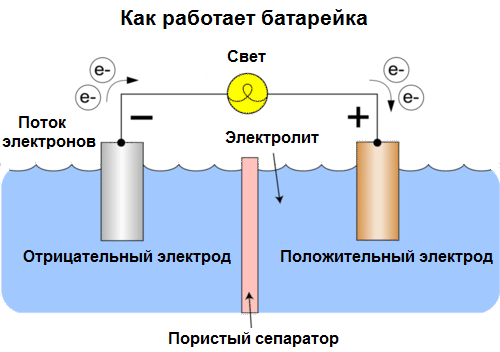
الجهد البطارية يعتمد على المعادن المستخدمة ، وعلى عدد الخلايا في "البطارية". لا تستطيع البطاريات ، على عكس البطاريات ، استعادة خواصها ، حيث إنها تقوم بتحويل الطاقة الكيميائية مباشرة ، أي طاقة الكواشف (المختزلة والمؤكسدة) التي تشكل البطارية ، إلى طاقة كهربائية.
يتم استهلاك الكواشف المضمنة في البطارية أثناء تشغيلها ، وينخفض التيار تدريجياً ، وبالتالي ، ينتهي عمل المصدر بعد تفاعل الكواشف بالكامل.
تُستخدم العناصر القلوية والملحية (البطاريات) على نطاق واسع لتشغيل مجموعة متنوعة من الأجهزة الإلكترونية ، وأجهزة الراديو ، والألعاب ، والليثيوم ، وغالبًا ما توجد في الأجهزة الطبية المحمولة مثل أجهزة قياس نسبة السكر في الدم أو في التكنولوجيا الرقمية مثل الكاميرات.

بطاريات الملح
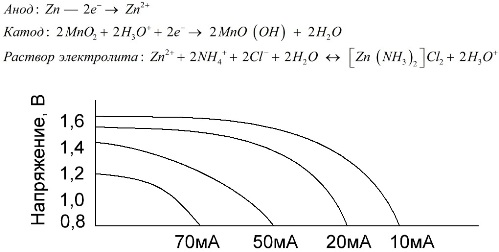
تعد خلايا المنغنيز والزنك ، والتي تسمى بطاريات الملح ، خلايا كلفانية "جافة" ، لا يوجد داخلها محلول إلكتروليت سائل.
قطب الزنك (+) عبارة عن كاثود على شكل كوب ، ويخدم خليط من ثاني أكسيد المنغنيز والجرافيت كأنود. التدفقات الحالية من خلال قضيب الجرافيت. ككهارل ، يتم استخدام عجينة من محلول كلوريد الأمونيوم مع إضافة النشا أو الدقيق إلى الثخانة ، بحيث لا يتدفق شيء.
عادة ، لا تشير الشركات المصنعة للبطارية إلى التكوين الدقيق لعناصر الملح ، ومع ذلك ، فإن بطاريات الملح هي الأقل تكلفة ، وعادة ما تستخدم في الأجهزة التي يكون فيها استهلاك الطاقة منخفضًا للغاية: في ساعات ، وفي أجهزة التحكم عن بعد ، وفي موازين الحرارة الإلكترونية ، إلخ.

نادراً ما يستخدم مفهوم "القدرة الاسمية" لوصف بطاريات المنغنيز والزنك ، حيث أن قدرتها تعتمد اعتمادًا كبيرًا على ظروف وظروف التشغيل. العيوب الرئيسية لهذه العناصر هي معدل كبير من خفض الجهد في جميع أنحاء التفريغ وانخفاض كبير في السعة الإخراج مع زيادة التفريغ الحالي. يتم ضبط الجهد التفريغ النهائي اعتمادا على الحمل في حدود 0.7-1.0 V.
من المهم ليس فقط حجم تيار التفريغ ، ولكن أيضًا الجدول الزمني للتحميل. مع التصريف المتقطع للتيارات الكبيرة والمتوسطة ، يزيد أداء البطاريات بشكل ملحوظ مقارنة بالتشغيل المستمر. ومع ذلك ، مع وجود تيارات تفريغ صغيرة وشهور من الانقطاعات في التشغيل ، قد تنخفض سعاتها نتيجة التفريغ الذاتي.
يوضح الرسم البياني أعلاه منحنيات التفريغ لبطارية ملح متوسطة لمدة 4 و 10 و 20 و 40 ساعة للمقارنة مع قلوية واحدة ، والتي سيتم مناقشتها لاحقًا.
البطاريات القلوية (القلوية)
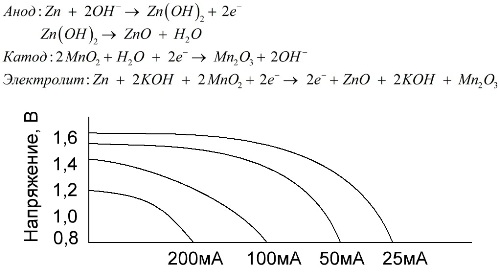
البطارية القلوية عبارة عن بطارية كلفانية منجنيز المنغنيز ، حيث يتم استخدام ثاني أكسيد المنغنيز كاثود ، ويستخدم الزنك المسحوق كأنود ، ويستخدم محلول قلوي ككهارل ، وعادةً ما يكون في شكل عجينة هيدروكسيد البوتاسيوم.
تتمتع هذه البطاريات بعدد من المزايا (بشكل خاص ، سعة أكبر بشكل كبير ، أداء أفضل في درجات حرارة منخفضة وتيارات تحميل عالية).

يمكن أن توفر البطاريات القلوية ، مقارنة بالبطاريات المالحة ، المزيد من التيار لفترة طويلة. يصبح التيار أكبر ممكنًا لأن الزنك يستخدم هنا ليس في شكل زجاج ، ولكن في شكل مسحوق به منطقة تلامس أكبر مع المنحل بالكهرباء. يستخدم هيدروكسيد البوتاسيوم في شكل عجينة ككهارل.
بفضل قدرة هذا النوع من الخلايا الكلفانية على توفير تيار هام (يصل إلى 1 أ) لفترة طويلة ، تعد البطاريات القلوية أكثر شيوعًا في الوقت الحالي.
في الألعاب الكهربائية ، وفي الأجهزة الطبية المحمولة ، وفي الأجهزة الإلكترونية ، وفي الكاميرات ، تُستخدم البطاريات القلوية في كل مكان. أنها تخدم 1.5 مرة أطول من المياه المالحة إذا كان التصريف منخفضة الحالية. يوضح الرسم البياني منحنيات التفريغ في التيارات المختلفة للمقارنة مع بطارية الملح (تم إعطاء الرسم البياني أعلاه) لمدة 4 و 10 و 20 و 40 ساعة.
بطاريات الليثيوم
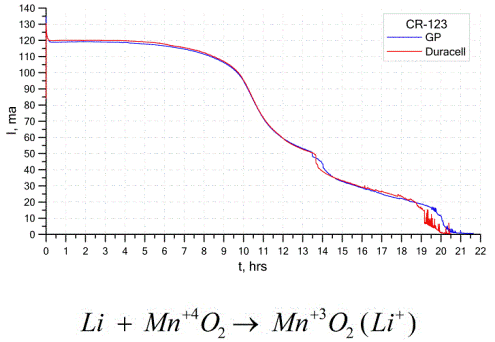
وهناك نوع آخر شائع إلى حد ما من الخلايا الكلفانية وهو بطاريات الليثيوم - خلايا كلفانية غير قابلة لإعادة الشحن يتم فيها استخدام الليثيوم أو مركباته كأنود. بسبب استخدام المعدن القلوي ، فإن لديهم فرق جهد كبير.

يمكن أن يكون الكاثود والكهارل لخلية الليثيوم مختلفين تمامًا ، لذا فإن مصطلح "خلية الليثيوم" يجمع بين مجموعة من الخلايا مع نفس مادة الأنود.ككاثود ، على سبيل المثال ، يمكن استخدام ثاني أكسيد المنغنيز ، أحادي فلوريد الكربون ، البايرايت ، كلوريد الثيونيل ، إلخ.
تتميز بطاريات الليثيوم عن غيرها من البطاريات بوقت تشغيلها المرتفع وتكلفتها العالية. اعتمادًا على الحجم المحدد والمواد الكيميائية المستخدمة ، يمكن أن تنتج بطارية الليثيوم الفولتية من 1.5 فولت (متوافق مع البطاريات القلوية) إلى 3.7 فولت.
تتمتع هذه البطاريات بأعلى سعة لكل وحدة كتلة وعمر افتراضي طويل. تُستخدم خلايا الليثيوم على نطاق واسع في الأجهزة الإلكترونية المحمولة الحديثة: لتشغيل الساعة على اللوحات الأم للكمبيوتر ، ولتزويد الأجهزة الطبية المحمولة والساعات والآلات الحاسبة وأجهزة التصوير الفوتوغرافي وما إلى ذلك.
يوضح الرسم البياني أعلاه منحنيات التفريغ لبطاريتي الليثيوم من مصنعين رائعين. كان التيار الأولي 120 مللي أمبير (لكل المقاوم من أجل 24 أوم).
انظر أيضا: البطاريات القابلة لإعادة الشحن الحديثة - مزايا وعيوب
انظر أيضا في electro-ar.tomathouse.com
: