فئات: كهربائيين المبتدئين, كهربائي صناعي
مرات المشاهدة: 37528
تعليقات على المقال: 0
التطبيق العملي للتحليل الكهربائي
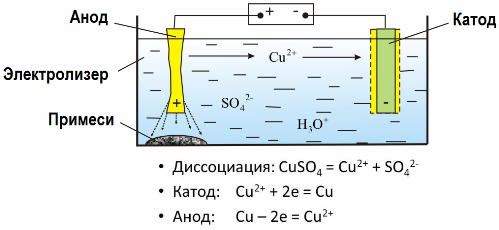
عندما يمر تيار كهربائي عبر محلول أو إذابة من المنحل بالكهرباء ، يتم إطلاق الأقطاب الذائبة أو المواد الأخرى التي تنتج عن التفاعلات الثانوية على الأقطاب الكهربائية على الأقطاب الكهربائية. هذه العملية الفيزيائية تسمى التحليل الكهربائي.
جوهر التحليل الكهربائي
في الحقل الكهربائي الناتج عن الأقطاب الكهربائية ، تأتي الأيونات الموجودة في السائل الموصل في حركة منظمة. القطب السلبي هو الكاثود ، والإيجابي هو الأنود.
الأيونات السالبة تسمى الأيونات (أيونات مجموعة الهيدروكسيل وبقايا الحمض) تندفع إلى الأنود ، والأيونات الموجبة تسمى الكاتيونات (الهيدروجين ، المعادن ، أيونات الأمونيوم ، إلخ) تسرع إلى الكاثود
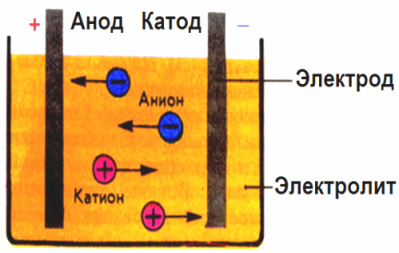
تحدث عملية الحد من الأكسدة في الأقطاب الكهربائية: يحدث الاختزال الكهروكيميائي للجزيئات (الذرات ، الجزيئات ، الكاتيونات) في الكاثود ، ويحدث التأكسد الكهروكيميائي للجزيئات (الذرات ، الجزيئات ، الأنيونات) عند الأنود. تفاعلات الانفصال في المنحل بالكهرباء هي تفاعلات أولية ، وتسمى التفاعلات التي تبدأ مباشرة في الأقطاب الكهربائية بالثانوية.
قوانين فاراداي التحليل الكهربائي
ساعد فصل تفاعلات التحليل الكهربائي إلى الابتدائي والثانوي مايكل فاراداي في وضع قوانين التحليل الكهربائي:
-
أول قانون للتحليل الكهربائي فاراداي: كتلة المادة المودعة على القطب الكهربائي خلال التحليل الكهربائي يتناسب طرديا مع كمية الكهرباء المنقولة إلى هذا القطب. يعني مقدار الكهرباء شحنة كهربائية ، تقاس ، كقاعدة عامة ، في المعلقات.
-
القانون الثاني لتحليل فاراداي: بالنسبة لكمية معينة من الكهرباء (الشحنة الكهربائية) ، تكون كتلة العنصر الكيميائي المودعة في القطب متناسبة مباشرة مع الكتلة المكافئة للعنصر. الكتلة المكافئة للمادة هي الكتلة المولية مقسومة على عدد صحيح ، وهذا يتوقف على التفاعل الكيميائي الذي تشارك فيه المادة.
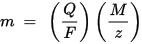
m هي كتلة المادة المودعة على القطب ، Q هي الشحنة الكلية الكهربائية التي تمر عبر المادة F = 96،485.33 (83) C mol - 1 هو ثابت Faraday ، M هي الكتلة المولية للمادة (على سبيل المثال ، الكتلة المولية للماء H2O = 18 جم / mol) ، z هو رقم التكافؤ لأيونات أي مادة (عدد الإلكترونات لكل أيون).
لاحظ أن M / z هي الكتلة المكافئة للمادة المترسبة. بالنسبة لقانون فاراداي الأول ، تكون M و F و z ثوابت ، لذا كلما كانت قيمة Q أكبر ، زادت قيمة m. بالنسبة لقانون Faraday الثاني ، Q و F و z هي ثوابت ، لذا كلما زادت قيمة M / z (الكتلة المكافئة) ، زادت قيمة m.
يستخدم التحليل الكهربائي اليوم على نطاق واسع في الصناعة والتكنولوجيا. على سبيل المثال ، يعد التحليل الكهربائي أحد أكثر الطرق فعالية للإنتاج الصناعي للهيدروجين ، بيروكسيد الهيدروجين ، ثاني أكسيد المنجنيز ، الألومنيوم ، الصوديوم ، المغنيسيوم ، الكالسيوم وغيرها من المواد. يستخدم التحليل الكهربائي لمعالجة مياه الصرف الصحي ، في الطلاء الكهربائي ، في الطلاء الكهربائي ، وأخيرا في مصادر التيار الكيميائي. لكن أول الأشياء أولا.
الحصول على المعادن النقية من الخامات عن طريق التحليل الكهربائي
بفضل التحليل الكهربائي ، يتم استخراج العديد من المعادن من الخامات وتخضع لمزيد من المعالجة. لذلك ، عندما يتم معالجة خام أو خام مخصب - مركز - بالكواشف ، يمر المعدن إلى المحلول ، وبعد ذلك ، بواسطة العزل الكهربائي ، يتم عزل المعدن عن المحلول. يتم إطلاق المعدن النقي في نفس الوقت في الكاثود. بهذه الطريقة تلقي الزنك والنحاس والكادميوم.
تتعرض المعادن للتصفية الإلكترونية لإزالة الشوائب ولتحويل الشوائب الموجودة إلى شكل مناسب لمزيد من المعالجة. يتم صب المعدن المراد تنظيفه على شكل ألواح ، وتستخدم هذه الصفائح كأنودات في التحليل الكهربائي.
عندما يمر التيار ، يذوب معدن الأنود ، ويمر في شكل الكاتيونات في المحلول ، ثم يتم تصريف الكاتيونات عند الكاثود وتشكيل ترسب من المعدن النقي. لا تتحلل الشوائب الموجودة في الأنود - فهي تترسب باستخدام ملاط الأنود ، أو تنتقل إلى المنحل بالكهرباء ، حيث يتم إزالتها بشكل مستمر أو دوري.
النظر كمثال النحاس الكهربائي. المكون الرئيسي للمحلول - كبريتات النحاس - الملح الأكثر شيوعا وأرخص من هذا المعدن. الحل لديه الموصلية الكهربائية منخفضة. لزيادة ذلك ، يضاف حمض الكبريتيك إلى المنحل بالكهرباء.
بالإضافة إلى ذلك ، يتم إدخال كميات صغيرة من المواد المضافة في المحلول لتسهيل تكوين رواسب معدنية مدمجة. بشكل عام ، يتعرض النحاس والنيكل والرصاص والقصدير والفضة والذهب للتكرير الكهربائي.
التحليل الكهربائي لمعالجة مياه الصرف الصحي
يستخدم التحليل الكهربائي في معالجة مياه الصرف الصحي (عمليات التخثير الكهربي والتخثير الكهربائي والتخطيط الكهربائي). طريقة التنظيف الكهروكيميائية هي واحدة من الأكثر استخداما. بالنسبة للتحليل الكهربائي ، يتم استخدام الأنودات غير القابلة للذوبان (المغنتيت ، وأكسيد الرصاص ، والجرافيت ، والمنغنيز ، والتي يتم ترسبها على قاعدة من التيتانيوم) ، أو قابلة للذوبان (الألومنيوم ، الحديد).
تستخدم هذه الطريقة لعزل المواد العضوية وغير العضوية السامة عن الماء. على سبيل المثال ، يتم تنظيف الأنابيب النحاسية على نطاق واسع بمحلول حمض الكبريتيك ، ثم يجب تنظيف مياه الصرف الصناعي عن طريق التحليل الكهربائي باستخدام أنود غير قابل للذوبان. يتم إطلاق النحاس في الكاثود ، والذي يمكن استخدامه مرة أخرى في نفس المؤسسة.
يتم تنقية مياه الصرف القلوية بواسطة التحليل الكهربائي من مركبات السيانيد. من أجل تسريع أكسدة السيانيد ، وزيادة التوصيل الكهربائي وتوفير الطاقة ، يتم استخدام مادة مضافة في شكل كلوريد الصوديوم في الماء.
يتم التحليل الكهربائي باستخدام أنود جرافيت وكاثود فولاذي. يتم تدمير السيانيد أثناء الأكسدة الكهروكيميائية والكلور ، والذي يتم إطلاقه على الأنود. فعالية هذا التنظيف قريبة من 100 ٪.
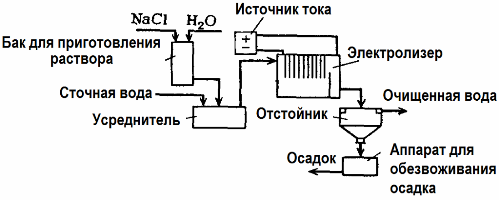
بالإضافة إلى التنظيف الكهروكيميائي المباشر ، يمكن تضمينه في عملية التحليل الكهربائي تجلط الدم. باستثناء إضافة الأملاح ، يتم إجراء التحليل الكهربائي باستخدام أنود ألومنيوم أو حديد قابل للذوبان. عندها لا يتم تدمير الملوثات الموجودة على الأنود فقط ، ولكن يذوب الأنود نفسه. تتشكل المركبات النشطة المشتتة التي تتخثر (تلوث) الملوثات الغروانية المشتتة.
هذه الطريقة فعالة في معالجة مياه الصرف الصحي من الدهون والمنتجات النفطية والأصباغ والزيوت والمواد المشعة ، وما إلى ذلك.
تعبئة
الطلي بالكهرباء هو الترسيب الكهربائي لبعض المعادن من أجل حماية المنتجات من التآكل ومنحها مظهرًا جماليًا مناسبًا (يتكون الطلاء من الكروم والنيكل والفضة والذهب والبلاتين وغيرها). يتم تنظيف الشيء جيدًا وإزالة الشحوم منه واستخدامه كاثود في حمام إلكتروليتي يتم فيه صب محلول ملح من المعدن الذي يلزم فيه طلاء المنتج.
يتم استخدام صفيحة من المعدن نفسه كأنود. كقاعدة عامة ، يتم استخدام زوج من لوحات الأنود ، ويتم وضع الموضوع المراد غلفنه بينهما.
galvanoplastics
الطلي - ترسيب المعدن على سطح أجسام مختلفة لإعادة إنتاج أشكالها: قوالب لأجزاء الصب ، والمنحوتات ، والكليشيات المطبوعة ، إلخ.

لا يمكن أن يحدث ترسب كلفاني للمعادن على سطح جسم ما إلا عندما يكون هذا السطح أو الكائن بأكمله عبارة عن موصل تيار كهربائي ، لذلك ينصح باستخدام المعادن في صنع نماذج أو أشكال. المعادن القابلة للانصهار هي الأكثر ملاءمة لهذا الغرض: الرصاص والقصدير والجنود وسبائك الخشب.
هذه المعادن ناعمة ويمكن معالجتها بسهولة باستخدام أدوات معدنية ، وهي محفورة بشكل جيد ومصبوب. بعد بناء الطبقة الجلفانية والتشطيب ، يتم صهر معدن القالب من المنتج النهائي.
ومع ذلك ، فإن أكبر الفرص لتصنيع النماذج لا تزال ممثلة بمواد عازلة. ولتعدين هذه النماذج ، من الضروري إعطاء الموصلية الكهربائية لسطحها. النجاح أو الفشل يعتمد بشكل أساسي على جودة الطبقة الموصلة. يمكن تطبيق هذه الطبقة بإحدى الطرق الثلاث.
الطريقة الأكثر شيوعا هي grafitirovanieإنها مناسبة لطرز البلاستيسين وغيرها من المواد التي تسمح بطحن الجرافيت على السطح.
الخدعة التالية هي البرنز، الطريقة جيدة لنماذج ذات شكل معقد نسبيًا ، للمواد المختلفة ، ولكن نظرًا لسمك الطبقة البرونزية ، فإن نقل الأجزاء الصغيرة مشوه إلى حد ما.
وأخيرا الجدرانياتمناسبة في جميع الحالات ، ولكن لا غنى عنها بشكل خاص للنماذج الهشة ذات الشكل المعقد للغاية - النباتات والحشرات ، إلخ.
مصادر التيار الكيميائي
يعد التحليل الكهربائي أيضًا العملية الرئيسية التي تعمل بها مصادر التيار الكيميائي الأكثر تقدمًا ، مثل البطاريات والمراكم. هناك نوعان من الأقطاب الكهربائية على اتصال بالكهرباء.
يوجد فرق محتمل بين الأقطاب الكهربائية - قوة دافعة كهربائية تقابل الطاقة الحرة لتفاعل الأكسدة والاختزال. انظر هنا لمزيد من التفاصيل: المصادر الكيميائية للتيار الكهربائي
بطارية الليمون (انقر على الصورة للتكبير)
يعتمد عمل مصادر التيار الكيميائي على حدوث عمليات منفصلة مكانيًا مع دارة خارجية مغلقة: على أنود سلبي ، يتأكسد عامل الاختزال ، وتنتقل الإلكترونات الحرة التي يتم تشكيلها عبر الدائرة الخارجية إلى الكاثود الموجب ، مما يخلق تيار تفريغ ، حيث يشاركون في تفاعل تقليل الأكسدة. وهكذا ، فإن تدفق الإلكترونات السالبة الشحنة على طول الدائرة الخارجية ينتقل من الأنود إلى الكاثود ، أي من القطب السالب إلى السالب الموجب.
انظر أيضا في electro-ar.tomathouse.com
: