فئات: مقالات مميزة » كهربائيين المبتدئين
مرات المشاهدة: 52646
تعليقات على المادة: 4
الترانزستورات. الجزء 2. الموصلات والعوازل وأشباه الموصلات
بداية المقال: تاريخ الترانزستور, الترانزستورات: الغرض والجهاز ومبادئ التشغيل
 في الهندسة الكهربائية ، يتم استخدام مواد مختلفة. يتم تحديد الخواص الكهربائية للمواد بعدد الإلكترونات الموجودة في مدار التكافؤ الخارجي. كلما كان عدد الإلكترونات في هذا المدار أقل ، كلما كانت ارتباطها بالنواة أضعف ، كلما كان من الأسهل الانتقال إليها.
في الهندسة الكهربائية ، يتم استخدام مواد مختلفة. يتم تحديد الخواص الكهربائية للمواد بعدد الإلكترونات الموجودة في مدار التكافؤ الخارجي. كلما كان عدد الإلكترونات في هذا المدار أقل ، كلما كانت ارتباطها بالنواة أضعف ، كلما كان من الأسهل الانتقال إليها.
تحت تأثير تقلبات درجة الحرارة ، تنفصل الإلكترونات عن الذرة وتتحرك في الفضاء بين الدولتين. تسمى هذه الإلكترونات بالمجان ، وتقوم بإنشاء تيار كهربائي في الموصلات. هل هناك مساحة كبيرة مشتركة بين الأقطار ، هل هناك مجال للإلكترونات الحرة للسفر داخل المادة؟
يبدو هيكل المواد الصلبة والسوائل مستمرًا وكثيفًا ، ويذكّر في بنية كرة الخيط. لكن في الواقع ، حتى المواد الصلبة تشبه شبكة صيد أو كرة طائرة. بالطبع ، لا يمكن تمييز ذلك على مستوى الأسرة ، لكن ثبت من خلال دراسات علمية دقيقة أن المسافات بين الإلكترونات ونواة الذرات أكبر بكثير من أبعادها الخاصة.
إذا تم عرض حجم النواة الذرية في شكل كرة بحجم كرة كرة ، فإن الإلكترونات في هذا النموذج ستكون بحجم حبة البازلاء ، وتقع كل حبة من هذه البازلاء من "النواة" على مسافة عدة مئات وحتى آلاف الأمتار. وبين النواة والإلكترون هو الفراغ - ببساطة لا يوجد شيء! إذا تخيلنا المسافات بين ذرات المادة على نفس النطاق ، فإن الأبعاد سوف تكون رائعة على الإطلاق - عشرات ومئات الكيلومترات!
الموصلات الجيدة للكهرباء المعادن. على سبيل المثال ، تحتوي ذرات الذهب والفضة على إلكترون واحد فقط في المدار الخارجي ، وبالتالي فهي أفضل الموصلات. الحديد يوصل الكهرباء أيضًا ، لكن الأسوأ قليلاً.
إجراء الكهرباء أسوأ سبائك عالية المقاومة. هذه هي نيتشروم ، المنغنين ، كونستانتين ، فيشرال وغيرها. يرجع السبب في هذه المجموعة المتنوعة من السبائك عالية المقاومة إلى حقيقة أنها مصممة لحل العديد من المشكلات: عناصر التسخين ، ومقاييس الضغط ، والمقاومات المرجعية لأجهزة القياس ، وأكثر من ذلك بكثير.
من أجل تقييم قدرة المواد على توصيل الكهرباء ، مفهوم "الموصلية الكهربائية". قيمة الإرجاع هي المقاومية. في الميكانيكا ، هذه المفاهيم تتوافق مع الثقل النوعي.
العوازلعلى عكس الموصلات ، لا يميلون إلى فقدان الإلكترونات. في داخلها ، تكون رابطة الإلكترون مع النواة قوية جدًا ، ولا توجد إلكترونات حرة تقريبًا. بتعبير أدق ، ولكن القليل جدا. في الوقت نفسه ، يوجد في بعض العوازل عدد أكبر منها ، وتكون جودة العزل لديها أسوأ من ذلك. يكفي مقارنة ، على سبيل المثال ، السيراميك والورق. لذلك ، يمكن تقسيم العوازل المشروطة إلى جيدة وسيئة.
يرجع ظهور الشحنات الحرة حتى في العوازل إلى الاهتزازات الحرارية للإلكترونات: تحت تأثير درجات الحرارة العالية ، تتدهور الخواص العازلة ، ولا تزال بعض الإلكترونات قادرة على الانفصال عن النواة.
وبالمثل ، فإن المقاومة للموصل المثالي سيكون صفر. لكن لحسن الحظ لا يوجد مثل هذا الموصل: تخيل كيف سيبدو قانون أوم ((I = U / R) مع صفر في المقام !!! وداعًا للرياضيات والهندسة الكهربائية.
وفقط عند درجة حرارة الصفر المطلقة (-273.2 درجة مئوية) ، تتوقف التقلبات الحرارية تمامًا ، ويصبح أسوأ عازل جيدًا بدرجة كافية. من أجل تحديد عددي "هذا" هو سيء - حسن استخدام مفهوم المقاومة. هذه هي المقاومة في أوم من مكعب بطول حافة من 1 سم ، يتم الحصول على البعد من المقاومة في أوم / سم. المقاومة المحددة لبعض المواد مبينة أدناه.الموصلية هي المتبادلة للمقاومة ، هي وحدة قياس سيمنز ، - 1Sm = 1 / أوم.
لديهم الموصلية الجيدة أو انخفاض المقاومة: الفضة 1.5 * 10 ^ (- 6) ، اقرأ كيف (واحد ونصف إلى عشرة إلى السلطة ناقص ستة) ، والنحاس 1.78 * 10 ^ (- 6) ، الألومنيوم 2.8 * 10 ^ (- 6). إن موصلية السبائك ذات المقاومة العالية أسوأ بكثير: كونستانتان 0.5 * 10 ^ (- 4) ، نيتشروم 1.1 * 10 ^ (- 4). يمكن أن تسمى هذه السبائك الموصلات السيئة. بعد كل هذه الأرقام المعقدة ، استبدل أوم / سم.
علاوة على ذلك ، في مجموعة منفصلة ، يمكن تمييز أشباه الموصلات: الجرمانيوم 60 أوم / سم ، السيليكون 5000 أوم / سم ، السيلينيوم 100 000 أوم / سم. تعتبر مقاومة هذه المجموعة أكبر من مقاومة الموصلات السيئة ، لكنها أقل من مقاومة العوازل السيئة ، ناهيك عن الموصلات الجيدة. ربما ، مع النجاح نفسه ، يمكن استدعاء أشباه الموصلات شبه عوازل.
بعد هذا التعارف القصير مع هيكل وخصائص الذرة ، ينبغي للمرء أن ينظر في كيفية تفاعل الذرات مع بعضها البعض ، كيف تتفاعل الذرات مع بعضها البعض ، وكيف تصنع الجزيئات منها ، والتي تتكون منها مواد مختلفة. للقيام بذلك ، يجب عليك مرة أخرى أن تتذكر الإلكترونات الموجودة في المدار الخارجي للذرة. بعد كل شيء ، هم الذين يشاركون في الترابط الذرات في الجزيئات وتحديد الخصائص الفيزيائية والكيميائية للمادة.
كيف تصنع الذرات من الذرات
أي ذرة في حالة مستقرة إذا كان هناك 8 إلكترونات في مدارها الخارجي. لا يسعى إلى أخذ إلكترونات من الذرات المجاورة ، لكنه لا يتخلى عن بلده. للتحقق من ذلك ، يكفي في الجدول الدوري أن ننظر إلى الغازات الخاملة: النيون ، الأرجون ، الكريبتون ، زينون. يحتوي كل منها على 8 إلكترونات في المدار الخارجي ، وهو ما يفسر إحجام هذه الغازات عن الدخول في أي علاقات (تفاعلات كيميائية) مع ذرات أخرى ، لبناء جزيئات من المواد الكيميائية.
الوضع مختلف تمامًا عن تلك الذرات التي ليس لديها 8 إلكترونات عزيزة في مدارها الخارجي. تفضل هذه الذرات أن تتحد مع الآخرين من أجل تكملة مدارها الخارجي بما يصل إلى 8 إلكترونات وإيجاد حالة مستقرة هادئة.
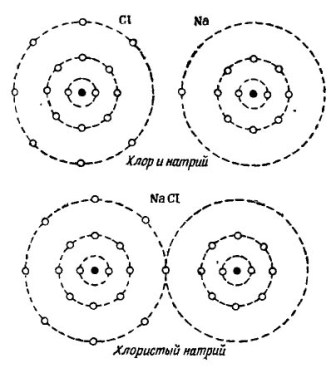
على سبيل المثال ، جزيء الماء المعروف H2O. يتكون من ذرتين هيدروجين و ذرة أكسجين واحدة ، كما هو موضح في الشكل. 1.
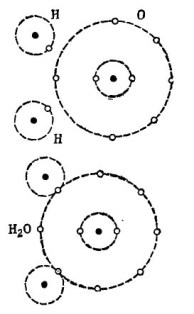
صور 1. كيف يتم إنشاء جزيء الماء.
في الجزء العلوي من الشكل ، تظهر ذرتان من الهيدروجين وذرة أكسجين واحدة بشكل منفصل. هناك 6 إلكترونات في المدار الخارجي للأكسجين واثنين من الإلكترونات في ذرتين الهيدروجين في مكان قريب. الأكسجين إلى أن يفقد العدد 8 العزيزة إلكترونين فقط في المدار الخارجي ، وهو ما سيحصل عليه بإضافة ذرتين من الهيدروجين إلى نفسه.
تفتقر كل ذرة هيدروجين إلى 7 إلكترونات في مدارها الخارجي لتحقيق السعادة الكاملة. تستقبل أول ذرة هيدروجين في مدارها الخارجي 6 إلكترونات من الأكسجين وإلكترون آخر من ذراتها - ذرة الهيدروجين الثانية. يوجد الآن 8 إلكترونات في مدارها الخارجي مع إلكترونها. تكمل ذرة الهيدروجين الثانية أيضًا مدارها الخارجي إلى الرقم 8. وتظهر هذه العملية في الجزء السفلي من الشكل. 1.
في الصورة 2 تظهر عملية الجمع بين ذرات الصوديوم والكلور. والنتيجة هي كلوريد الصوديوم ، الذي يباع في متاجر تسمى الملح.
صور 2. عملية الجمع بين ذرات الصوديوم والكلور
هنا ، أيضًا ، يتلقى كل من المشاركين العدد المفقود من الإلكترونات من الآخر: الكلور يربط إلكترون صوديوم واحد بإلكتروناته السبعة الخاصة ، بينما يعطي ذراته لذرة الصوديوم. تحتوي كلتا الذرتين في المدار الخارجي على 8 إلكترونات ، حيث يتحقق التوافق الكامل والازدهار.
تكاثر الذرات
تميل الذرات ذات 6 أو 7 إلكترونات في مدارها الخارجي إلى ربط إلكترون واحد أو إلكترونين بها. يقولون عن هذه الذرات أنها واحدة أو ثنائية التكافؤ. ولكن إذا كان في المدار الخارجي لذرة 1 أو 2 أو 3 إلكترونات ، فإن هذه الذرة تميل إلى التخلي عنها. في هذه الحالة ، تعتبر الذرة واحدة أو اثنتين أو ثلاثية.
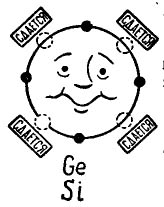
إذا كان هناك 4 إلكترونات في المدار الخارجي للذرة ، فإن هذه الذرة تفضل أن تتحد مع الإلكترون نفسه ، والذي يحتوي أيضًا على 4 إلكترونات. هكذا تتحد ذرات الجرمانيوم والسليكون المستخدمة في تصنيع الترانزستورات. في هذه الحالة ، تسمى الذرات tetravalent. (يمكن دمج ذرات الجرمانيوم أو السيليكون مع عناصر أخرى ، على سبيل المثال ، الأكسجين أو الهيدروجين ، ولكن هذه المركبات ليست مثيرة للاهتمام في خطة قصتنا.)
في الصورة 3 تظهر ذرة جرمانيوم أو سُليكون التي ترغب في الاندماج مع ذرة واحدة. الدوائر السوداء الصغيرة هي الإلكترونات الخاصة بالذرة ، وتشير الدوائر الضوئية إلى الأماكن التي تسقط فيها إلكترونات الذرات الأربعة - الجيران -.
صور 3. ذرة الجرمانيوم (السيليكون).
التركيب البلوري لأشباه الموصلات
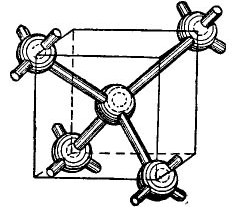
توجد ذرات الجرمانيوم والسيليكون في الجدول الدوري في نفس المجموعة مع الكربون (الصيغة الكيميائية للماس C هي ببساطة بلورات كربونية كبيرة يتم الحصول عليها في ظل ظروف معينة) ، وبالتالي ، عند الجمع ، تشكل بنية بلورية تشبه الماس. يظهر تشكيل مثل هذا الهيكل ، في شكل مبسط ، بالطبع ، في الشكل 4.
صور 4.
في وسط المكعب توجد ذرة جرمانيوم ، وتوجد 4 ذرات أخرى في الزوايا. ترتبط الذرة الموجودة في وسط المكعب بإلكترونات التكافؤ إلى أقرب جيرانها. في المقابل ، تعطي الذرات الزاوية إلكترونات التكافؤ إلى الذرة الموجودة في وسط المكعب وجيرانه - الذرات غير المبينة في الشكل. وبالتالي ، يتم استكمال المدارات الخارجية بما يصل إلى ثمانية إلكترونات. بالطبع ، لا يوجد مكعب في الشبكة البلورية ، يظهر فقط في الشكل بحيث يكون الترتيب المتبادل الحجمي للذرات واضحًا.
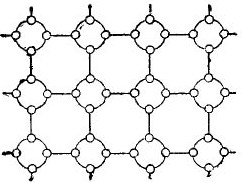
ولكن من أجل تبسيط القصة حول أشباه الموصلات إلى أقصى حد ممكن ، يمكن تصوير الشبكة البلورية كرسومات تخطيطية مسطحة ، على الرغم من حقيقة أن الروابط بين الذرية تقع في الفضاء. تظهر هذه الدائرة في الشكل. 5.
صور 5. شعرية الكريستال الجرمانيوم في شكل مسطح.
في مثل هذه البلورة ، يتم ربط جميع الإلكترونات بحزم مع الذرات بواسطة روابط التكافؤ ، وبالتالي ، على ما يبدو ، لا توجد ببساطة إلكترونات حرة هنا. اتضح أنه أمامنا عازل في الشكل ، لأنه لا توجد إلكترونات حرة فيه. ولكن ، في الواقع ، هذا ليس كذلك.
الموصلية الجوهرية
والحقيقة هي أنه تحت تأثير درجة الحرارة ، لا تزال بعض الإلكترونات قادرة على الانفصال عن ذراتها ، وتحرر نفسها لبعض الوقت من الرابطة مع النواة. لذلك ، توجد كمية صغيرة من الإلكترونات الحرة في بلورة الجرمانيوم ، والتي من الممكن أن تجري فيها تيار كهربائي. كم عدد الإلكترونات الحرة الموجودة في بلورة الجرمانيوم في ظل الظروف العادية؟
لا يوجد أكثر من إلكترونين حرين لكل ذرة 10 ^ 10 (عشرة مليارات) ، لذلك فإن الجرمانيوم موصل ضعيف ، أو كما هو معتاد أن يقول أشباه الموصلات. تجدر الإشارة إلى أن غرامًا واحدًا فقط من الجرمانيوم يحتوي على 10 ^ 22 (عشرة آلاف مليار مليار) ذرة ، مما يتيح لك "الحصول على" حوالي ألفي مليار إلكترون حر. يبدو أنه يكفي لتمرير تيار كهربائي كبير. للتعامل مع هذه المشكلة ، يكفي أن نتذكر ما تيار 1 أ.
تيار من 1 أ يتوافق مع المرور عبر موصل في ثانية واحدة شحنة كهربائية تبلغ 1 كولوم ، أو 6 * 10 ^ 18 (ستة مليارات مليار) إلكترون في الثانية. على هذه الخلفية ، من غير المرجح أن يضمن ألفي مليار إلكترون حر ، وحتى منتشرة على بلورة ضخمة ، مرور التيارات العالية. على الرغم من الحركة الحرارية ، توجد الموصلية الصغيرة في ألمانيا. هذا هو ما يسمى الموصلية الجوهرية.
الموصلية الإلكترونية وثقب
مع ارتفاع درجة الحرارة ، يتم نقل طاقة إضافية إلى الإلكترونات ، وتصبح اهتزازاتها الحرارية أكثر نشاطًا ، ونتيجة لذلك تمكنت بعض الإلكترونات من الانفصال عن ذراتها.تصبح هذه الإلكترونات حرة ، وفي حالة عدم وجود مجال كهربائي خارجي ، تقوم بحركات عشوائية وتتحرك في الفضاء الحر.
لا يمكن للذرات التي فقدت الإلكترونات أن تحدث حركات عشوائية ، ولكنها تتأرجح قليلاً مقارنةً بموضعها الطبيعي في الشبكة البلورية. وتسمى هذه الذرات ، التي فقدت الإلكترونات ، الأيونات الإيجابية. يمكننا أن نفترض أنه بدلاً من الإلكترونات الممزقة من ذراتها ، يتم الحصول على فراغات ، والتي عادة ما تسمى الثقوب.
بشكل عام ، يكون عدد الإلكترونات والثقوب هو نفسه ، لذلك يمكن للثقب التقاط إلكترون قريب. نتيجة لذلك ، تصبح ذرة أيون موجب محايدة مرة أخرى. تسمى عملية الجمع بين الإلكترونات والثقوب إعادة التركيب.
في نفس التردد ، يتم فصل الإلكترونات عن الذرات ، وبالتالي ، في المتوسط ، يكون عدد الإلكترونات والثقوب لأشباه الموصلات المعينة مساوياً ، ثابتًا ويعتمد على الظروف الخارجية ، وخاصة درجة الحرارة.
إذا تم تطبيق الجهد على بلورات أشباه الموصلات ، فسيتم طلب حركة الإلكترون ، وسوف يتدفق التيار عبر البلورة بسبب الموصلية الإلكترونية للفتحة والثقب. يسمى هذا الموصلية جوهري ، وقد سبق ذكره أعلى قليلاً.
لكن أشباه الموصلات في شكلها النقي ، والتي لها موصلية إلكترونية وثقب ، غير مناسبة لتصنيع الثنائيات ، الترانزستورات ، وغيرها من التفاصيل ، لأن أساس هذه الأجهزة هو تقاطع p-n (اقرأ "pe-en").
للحصول على مثل هذا الانتقال ، هناك حاجة إلى نوعين من أشباه الموصلات ، نوعان من الموصلية (p - إيجابي - إيجابي ، ثقب) و (n - سلبي - سلبي ، إلكتروني). يتم الحصول على هذه الأنواع من أشباه الموصلات عن طريق المنشطات ، إضافة الشوائب إلى بلورات الجرمانيوم أو السيليكون النقي.
على الرغم من أن كمية الشوائب صغيرة جدًا ، فإن وجودها يغير إلى حد كبير خصائص أشباه الموصلات ، ويسمح لك بالحصول على أشباه الموصلات ذات الموصلية المختلفة. سيتم مناقشة هذا في الجزء التالي من المقال.
بوريس الأديشين ، electro-ar.tomathouse.com
انظر أيضا في electro-ar.tomathouse.com
: